Bedeutung von Biofilmen
Kontakt

Prof. Dr. rer. nat.
Bernd Kreikemeyer
- Professor für Molekulare Bakteriologie
am Institut für Medizinische Mikrobiologie,
Virologie und Hygiene
+49 (0) 381 494 5950
+49 (0) 381 494 5919
+49 (0) 381 494 5902
bernd.kreikemeyer{bei}med.uni-rostock.de
Bedeutung
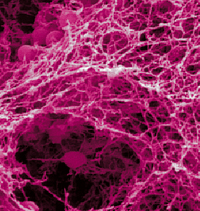
Biofilme sind ein dünner Überzug aus Mikroorganismen und einer von diesen Zellen gebildeten interzellulären Substanz auf sehr vielen Oberflächen der irdischen Biosphäre. Biofilme sind damit die entwicklungsgeschichtlich älteste und gleichzeitig immer noch häufigste vielzellige Daseinsform. Die Biofilmstruktur ermöglicht den darin organisierten Mikroorganismen eine relativ konstante Zufuhr von Nährstoffen und Schutz gegen sehr viele widrige Einflüsse wie Strömungen der umgebenden Flüssigkeit, Austrocknung, UV-Licht, pH-Schwankungen, toxische Substanzen, Bakteriophagen und nicht zuletzt allen Abwehrmechanismen des Menschen.
Damit sind einmal auf einer menschlichen Oberfläche bzw. in einem Gewebe gebildete Biofilme kaum wieder zu beseitigen - weder durch die Wirtsabwehr noch durch äußerliche (ärztliche) Maßnahmen.
Insofern sind pathogene Biofilme im Menschen meist mit chronischen Entzündungen / Infektionen assoziiert. Insbesondere wenn Fremdkörper in den Menschen eingebracht werden, entwickeln sich auf diesen häufig Biofilme. Diese gefährden wiederum das dauerhafte Verweilen des Fremdkörpers im Gewebe. Das kann für den betroffenen Menschen dramatisch sein, wenn der Fremdkörper ein lebenswichtiges Implantat ist.
Weltweit gibt es zahlreiche Forschungsinitiativen, um die Pathogenese von Biofilm-Infektionen zu verstehen. Die Parodontitis ist ein bei praktisch allen Menschen im Verlauf ihres Lebens nachzuweisendes Beispiel für eine Biofilm-Infektion, die den Halt der Zähne bedroht und zu lokalen wie auch systemischen Komplikationen führen kann.
Noch häufiger wird erforscht, inwieweit Implantate mit Oberflächen versehen werden können, auf denen keine Biofilme mehr gedeihen bzw. wie man Biofilme von bereits besiedelten Implantat-Oberflächen wieder beseitigen kann. Diese Bemühungen sind für die Standzeiten z.B. von Gelenkprothesen von höchster Bedeutung.
Themenkomplexe
Folgende Themenkomplexe werden in diesem Zusammenhang in den Forschungslabors des Institutes bearbeitet:
Installierung und Optimierung von Kulturbedingungen für Mischspeziesbiofilme mit parodontopathogenen Bakterien
laufende Verbesserung von Kulturtechniken zur Untersuchung von Erregern im Zusammenhang mit Implantat-Biofilmen
in situ Hybridierung, metabolische Markierung und Antikörpertechniken zur Sichtbarmachung der beteiligten Bakterien
mikroskopische Darstellung der räumlichen Zuordnung der Bakterien in Biofilmen
Genexpressions- und Proteomänderungen bei Biofilmwachstum
Beeinflussung des Biofilmwachstums durch Modifikation der Zieloberflächen sowie durch Protektion / Behandlung mit Antiseptika / Probiotika
Arbeitsgruppen auf diesem Gebiet
Inhaltsverzeichnis
